Trong đời sống và sản xuất, kim loại xuất hiện khắp nơi từ dây điện, nồi, xoong cho đến máy móc. Để hiểu cách sử dụng và bảo quản hiệu quả, cần nắm vững tính chất hóa học của kim loại. Cùng tìm hiểu chi tiết qua bài viết dưới đây.
Tính chất hóa học của kim loại
1.Khái niệm kim loại và tính chất hóa học cơ bản
1.1.Khái niệm kim loại
Kim loại là nhóm nguyên tố chiếm phần lớn trong bảng tuần hoàn, thường có bề mặt bóng kim loại, khả năng dẫn điện và dẫn nhiệt tốt, dễ kéo sợi và dát mỏng. Điểm đặc trưng của kim loại là có electron ở lớp ngoài cùng dễ mất, do đó chúng dễ tham gia vào các phản ứng hóa học. Các kim loại bao gồm nhiều nhóm như kim loại kiềm, kim loại kiềm thổ, kim loại chuyển tiếp và các kim loại khác, mỗi nhóm có mức độ hoạt động khác nhau.
Về tính chất hóa học cơ bản, kim loại có khả năng phản ứng với phi kim, axit và nước, thể hiện mức độ hoạt động hóa học và quyết định ứng dụng thực tế trong đời sống và công nghiệp.
1.2.Tính chất hóa học của kim loại
Kim loại tác dụng với phi kim
Kim loại phản ứng với các phi kim như oxi, clo, lưu huỳnh để tạo oxit hoặc muối kim loại. Phản ứng này thường tỏa nhiệt và tạo sản phẩm ổn định.
- Ví dụ, natri (Na) tác dụng với clo (Cl₂) tạo ra muối ăn thông dụng: 2Na + Cl2 → 2NaCl
- Kim loại kiềm hoạt động mạnh với phi kim, phản ứng nhanh và tỏa nhiệt mạnh. Trong khi đó, các kim loại quý như vàng, bạc hầu như không phản ứng với phi kim ở điều kiện thường.
Những phản ứng này rất quan trọng trong công nghiệp hóa chất và sản xuất hợp kim, giúp tạo ra các muối, oxit và vật liệu có ứng dụng rộng rãi trong đời sống.
>> Tham khảo: Súng thổi ion SL004

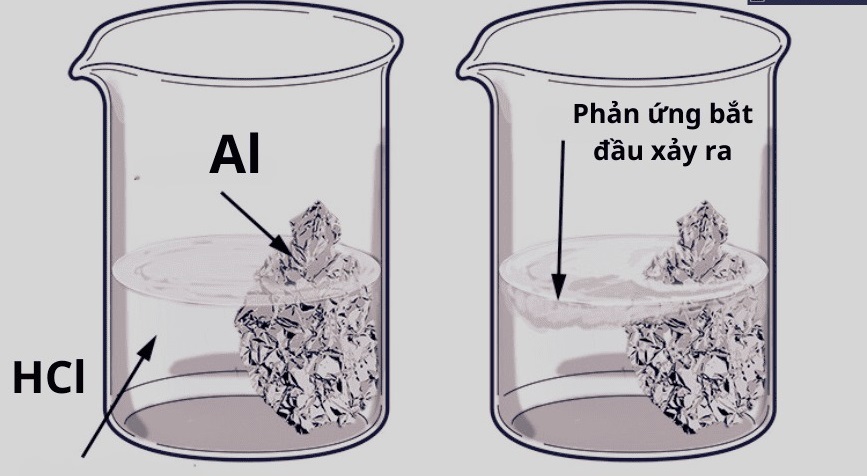
Kim loại tác dụng với axit
Kim loại khi tác dụng với axit loãng sẽ tạo ra muối và giải phóng khí hiđro (H₂). Đây là phản ứng đặc trưng giúp đánh giá mức độ hoạt động hóa học của kim loại.
- Ví dụ, kẽm (Zn) tác dụng với axit clohidric (HCl) tạo ra muối kẽm clorua và khí hiđro: Zn + 2HCl → ZnCl2 + H2↑
- Kim loại hoạt động mạnh như kẽm, sắt phản ứng nhanh, trong khi kim loại quý như bạc, vàng hầu như không phản ứng với axit loãng.
Phản ứng này không chỉ giải thích các hiện tượng hóa học mà còn được ứng dụng trong sản xuất khí hiđro và muối kim loại trong công nghiệp.
Kim loại tác dụng với nước
Một số kim loại, đặc biệt là kim loại kiềm, phản ứng với nước tạo bazơ và khí hiđro. Mức độ phản ứng phụ thuộc vào nhóm kim loại:
- Kim loại kiềm (Na, K): phản ứng mạnh, tỏa nhiệt, tạo bazơ mạnh: 2Na + 2H2O → 2NaOH + H2↑
- Kim loại kiềm thổ (Ca, Mg): phản ứng chậm hơn, đôi khi cần nước nóng: Ca + 2H2O → Ca(OH)2 + H2↑
- Các kim loại ít hoạt động (Cu, Ag, Au): hầu như không phản ứng với nước ở điều kiện thường, chỉ phản ứng trong môi trường đặc biệt hoặc dung dịch kiềm đặc.
Hiểu rõ phản ứng của kim loại với nước giúp ứng dụng kim loại đúng cách, tránh nguy cơ ăn mòn hoặc gây nguy hiểm trong đời sống và công nghiệp.
Tính chất hóa học cơ bản của kim loại gồm phản ứng với phi kim, axit và nước, phụ thuộc vào số electron lớp ngoài cùng, vị trí trong bảng tuần hoàn và mức độ hoạt động hóa học. Những kiến thức này là nền tảng quan trọng để ứng dụng kim loại hiệu quả, chế tạo hợp kim, sản xuất vật liệu và đảm bảo an toàn trong sử dụng.
2.Yếu tố ảnh hưởng đến tính chất hóa học của kim loại
Tính chất hóa học kim loại không chỉ phụ thuộc vào bản thân kim loại mà còn chịu ảnh hưởng từ nhiều yếu tố khác nhau. Việc hiểu rõ các yếu tố này giúp dự đoán phản ứng, lựa chọn kim loại phù hợp và ứng dụng hiệu quả trong đời sống và công nghiệp.
Số electron lớp ngoài cùng
- Kim loại có 1 hoặc 2 electron ở lớp ngoài cùng hoạt động hóa học mạnh hơn các kim loại có nhiều electron lớp ngoài cùng hơn.
- Ví dụ, kim loại kiềm (Na, K) chỉ có 1 electron ngoài cùng nên phản ứng với phi kim, axit hay nước rất mạnh. Ngược lại, kim loại chuyển tiếp (Cu, Ag) có nhiều electron ở lớp ngoài nên ít phản ứng hơn.

Vị trí trong bảng tuần hoàn
- Nhóm kim loại xác định mức độ hoạt động hóa học:
- Kim loại nhóm IA (kiềm) và IIA (kiềm thổ) thường hoạt động mạnh.
- Kim loại chuyển tiếp hoạt động yếu hơn.
- Kim loại nhóm B hoặc quý như Au, Ag hầu như không phản ứng với axit loãng hay nước.
- Chu kỳ trong bảng tuần hoàn cũng ảnh hưởng: kim loại ở dưới cùng của nhóm hoạt động mạnh hơn kim loại ở trên cùng (do electron lớp ngoài xa hạt nhân hơn, dễ mất).
Môi trường và điều kiện phản ứng
- Nhiệt độ: Khi tăng nhiệt độ, các nguyên tử dao động mạnh hơn, giúp phản ứng xảy ra nhanh và mạnh hơn.
- Dung dịch hoặc môi trường hóa học: Môi trường axit mạnh, bazơ hay muối có thể tăng hoặc giảm tốc độ phản ứng kim loại.
- Oxy hóa hoặc ăn mòn bề mặt: Kim loại bị oxy hóa sẽ giảm khả năng phản ứng, ảnh hưởng đến hiệu suất hóa học trong thực tế.
Ảnh hưởng của hợp kim và tạp chất
- Kim loại nguyên chất thường phản ứng mạnh hơn hợp kim hoặc kim loại pha tạp chất.
- Ví dụ: đồng nguyên chất phản ứng tốt hơn đồng pha thiếc (dùng trong đồ đồng thau).
- Tạp chất làm electron di chuyển khó hơn, làm giảm mức độ hoạt động hóa học.
Các yếu tố chính ảnh hưởng đến tính chất hóa học kim loại bao gồm: số electron lớp ngoài cùng, vị trí trong bảng tuần hoàn, môi trường phản ứng, nhiệt độ, oxy hóa bề mặt và tạp chất trong kim loại. Hiểu rõ các yếu tố này giúp dự đoán phản ứng, lựa chọn kim loại phù hợp và ứng dụng hiệu quả trong đời sống, công nghiệp và sản xuất hợp kim.
3.Ứng dụng của tính chất hóa học của kim loại
Tính chất hóa học của kim loại không chỉ là kiến thức lý thuyết mà còn có ý nghĩa quan trọng trong đời sống, công nghiệp và sản xuất vật liệu. Hiểu rõ cách kim loại phản ứng với phi kim, axit, nước và các hợp chất khác giúp chúng ta ứng dụng hiệu quả, an toàn và tiết kiệm chi phí.
Ứng dụng trong đời sống
- Dây dẫn điện và thiết bị điện: Kim loại như đồng (Cu) và nhôm (Al) được sử dụng làm dây dẫn nhờ khả năng dẫn điện tốt và ổn định, ít bị oxi hóa.
- Chế tạo đồ gia dụng: Nồi, xoong, chảo thường sử dụng kim loại chịu ăn mòn hoặc mạ lớp bảo vệ để phản ứng hóa học với thực phẩm ít xảy ra.
- Pin và ắc quy: Tận dụng khả năng kim loại phản ứng với axit hoặc bazơ để tạo ra dòng điện. Ví dụ, kẽm trong pin phản ứng với dung dịch axit tạo ra điện năng.
Ứng dụng trong công nghiệp
- Luyện kim và sản xuất hợp kim: Dựa vào phản ứng với phi kim để tạo oxit, muối và hợp kim có tính chất cơ học và hóa học mong muốn.
- Sản xuất hóa chất: Kim loại phản ứng với axit hoặc phi kim để tạo ra muối kim loại, khí hiđro, oxit, phục vụ sản xuất phân bón, thuốc, vật liệu xây dựng.
- Động cơ và máy móc: Lựa chọn kim loại dựa trên tính chất hóa học để chống ăn mòn, duy trì hiệu suất, kéo dài tuổi thọ thiết bị.
Ứng dụng trong năng lượng và môi trường
- Năng lượng tái tạo: Kim loại như kẽm, niken, lithium dùng trong pin năng lượng mặt trời, pin lithium-ion nhờ phản ứng hóa học tạo điện năng hiệu quả.
- Xử lý môi trường: Một số kim loại dùng để khử kim loại nặng, xử lý nước thải nhờ phản ứng hóa học với các ion và hợp chất trong môi trường.
Hiểu và áp dụng tính chất hóa học kim loại giúp chúng ta sử dụng kim loại đúng cách trong đời sống, chế tạo vật liệu, sản xuất điện năng, xử lý môi trường và công nghiệp, đồng thời giảm thiểu ăn mòn, tiết kiệm chi phí và tăng độ bền cho thiết bị.
4.Lưu ý khi sử dụng kim loại dựa trên tính chất hóa học
Hiểu rõ tính chất hóa học của kim loại không chỉ giúp dự đoán phản ứng mà còn là cơ sở quan trọng để sử dụng kim loại an toàn, bền bỉ và hiệu quả trong đời sống và công nghiệp. Khi áp dụng kim loại vào thực tế, cần lưu ý các điểm sau:
Tránh ăn mòn và oxy hóa
- Nhiều kim loại như sắt, kẽm, đồng dễ bị oxy hóa hoặc ăn mòn khi tiếp xúc với nước, axit, muối hoặc không khí ẩm.
- Giải pháp: sử dụng lớp phủ bảo vệ, sơn, mạ kẽm hoặc hợp kim chống ăn mòn để kéo dài tuổi thọ kim loại.
Chọn vật liệu phù hợp với môi trường
- Kim loại hoạt động mạnh như kim loại kiềm (Na, K) không nên sử dụng trong môi trường ẩm hoặc tiếp xúc trực tiếp với nước.
- Kim loại ít hoạt động như vàng, bạc thích hợp cho thiết bị tiếp xúc hóa chất hoặc đồ trang sức nhờ khả năng chống phản ứng hóa học.
Tính toán đúng công suất và chịu tải
- Trong dây dẫn và thiết bị điện, kim loại dẫn điện tốt như đồng, nhôm phải được lựa chọn theo tiết diện và công suất tiêu thụ để tránh quá nhiệt, cháy nổ.
- Việc lựa chọn sai kim loại có thể dẫn đến mất điện, giảm tuổi thọ thiết bị hoặc nguy cơ hỏa hoạn.
Lưu ý khi kết hợp kim loại
- Khi hai kim loại khác nhau tiếp xúc trong môi trường ẩm, có thể xảy ra ăn mòn điện hóa (hiện tượng pin điện hóa).
- Giải pháp: sử dụng lớp cách điện hoặc chọn hợp kim phù hợp để ngăn chặn ăn mòn.
Kiểm tra và bảo dưỡng định kỳ
- Thường xuyên kiểm tra bề mặt kim loại, loại bỏ gỉ sét hoặc các tạp chất.
- Bảo dưỡng kim loại giúp duy trì tính chất hóa học, đảm bảo an toàn và hiệu suất sử dụng lâu dài.
Khi sử dụng kim loại, cần lưu ý ăn mòn, oxy hóa, môi trường sử dụng, chịu tải, kết hợp kim loại và bảo dưỡng định kỳ. Việc áp dụng đúng kiến thức về tính chất hóa học kim loại sẽ giúp kéo dài tuổi thọ, tiết kiệm chi phí và đảm bảo an toàn trong đời sống và công nghiệp.
Trên đây HMTech đã tổng hợp chi tiết về tính chất hóa học của kim loại, giải thích các phản ứng với phi kim, axit, nước, yếu tố ảnh hưởng và ứng dụng thực tiễn trong đời sống, công nghiệp cũng như sản xuất hợp kim. Hy vọng bài viết sẽ giúp bạn hiểu rõ và sử dụng kim loại một cách hiệu quả, an toàn và tiết kiệm.


