Bài viết giúp bạn hiểu rõ tính chất hóa học của kim loại, từ phản ứng với phi kim, axit, dung dịch muối đến nước. Giải thích dễ hiểu, kèm ví dụ minh họa và ứng dụng trong đời sống.
Tính chất hóa học của kim loại
1. Bản chất và đặc điểm chung của tính chất hóa học của kim loại
Kim loại là một nhóm nguyên tố đặc biệt quan trọng trong hóa học và trong đời sống thực tế. Từ những chiếc dây điện bằng đồng, các thiết bị điện tử phủ vàng, cho đến những thanh nhôm trong khung cửa, tất cả đều gắn liền với đặc trưng nổi bật của kim loại – khả năng tham gia nhiều phản ứng hóa học khác nhau. Hiểu rõ tính chất hóa học của kim loại không chỉ giúp ta nắm vững lý thuyết mà còn giải thích được rất nhiều hiện tượng trong tự nhiên và trong công nghiệp hiện đại.
Bản chất hóa học của kim loại
Kim loại có đặc điểm nổi bật là dễ nhường electron, hình thành ion dương trong các phản ứng. Chính khả năng này khiến kim loại mang tính khử mạnh, nghĩa là chúng có xu hướng bị oxi hóa khi phản ứng với các chất khác. Một nguyên tử kim loại điển hình như natri sẽ nhường đi một electron để trở thành ion Na⁺ ổn định hơn. Quá trình này chính là nguyên nhân khiến kim loại dễ phản ứng trong nhiều môi trường khác nhau.
Khi quan sát dãy điện hóa của kim loại, ta thấy rằng các nguyên tố như kali, natri, canxi và magie nằm ở vị trí đầu, có khả năng nhường electron rất dễ dàng, nên hoạt động hóa học của chúng mạnh hơn hẳn so với các kim loại như đồng hay bạc ở cuối dãy. Dãy điện hóa này là cơ sở để dự đoán và so sánh độ mạnh yếu của phản ứng giữa các kim loại.
Ý nghĩa của đặc tính hóa học
Tính khử của kim loại đóng vai trò quan trọng trong nhiều lĩnh vực. Nó giúp con người khai thác, tinh luyện và tái chế kim loại từ quặng, chế tạo hợp kim, thực hiện các phản ứng điện phân và mạ kim loại. Nhờ khả năng phản ứng mạnh, kim loại có thể tham gia vào rất nhiều loại phản ứng khác nhau như với phi kim, với dung dịch axit, với nước và với dung dịch muối.
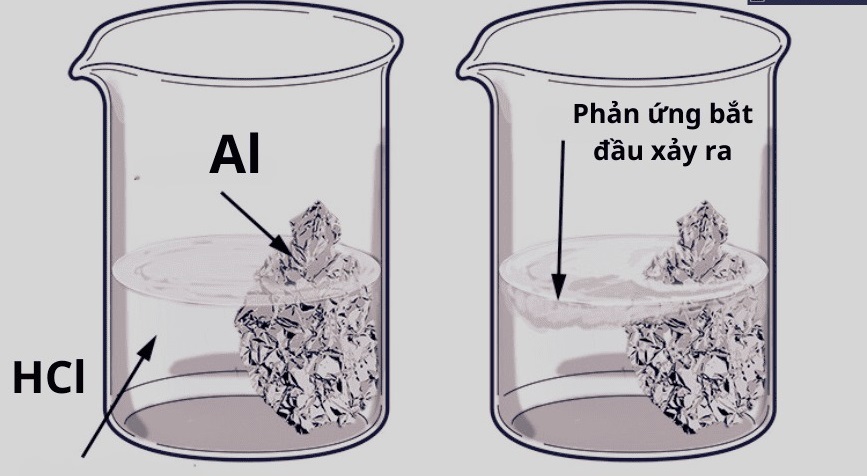
Khi kim loại phản ứng với axit, khí hiđro được tạo thành và thoát ra dưới dạng bọt khí
2. Phản ứng giữa kim loại và phi kim
Kim loại phản ứng với oxi
Khi tiếp xúc với oxi ở điều kiện thích hợp, hầu hết kim loại đều phản ứng tạo thành oxit kim loại. Đây là phản ứng oxi hóa điển hình thể hiện rõ tính khử của kim loại. Chẳng hạn, khi đốt magie trong không khí, ngọn lửa sáng chói xuất hiện do phản ứng giữa magie và oxi tạo ra magie oxit. Tương tự, natri phản ứng nhanh với oxi tạo natri oxit. Những oxit này khi tan trong nước thường sinh ra dung dịch kiềm, ví dụ natri oxit tạo natri hiđroxit.
Phản ứng của kim loại với oxi không chỉ mang tính lý thuyết mà còn rất quen thuộc trong đời sống. Hiện tượng sắt bị gỉ khi để lâu trong không khí ẩm thực chất cũng là quá trình oxi hóa tạo thành oxit sắt.
Kim loại phản ứng với phi kim khác
Ngoài oxi, kim loại còn phản ứng với nhiều phi kim khác như clo, lưu huỳnh hay brom. Sắt khi nung nóng phản ứng với clo sinh ra muối sắt (III) clorua, còn khi tác dụng với lưu huỳnh lại tạo ra sắt (II) sunfua. Đây là những phản ứng tỏa nhiệt mạnh, thường xảy ra khi có nhiệt độ cao. Trong công nghiệp, các phản ứng này được ứng dụng để sản xuất muối clorua, hợp chất sunfua và nhiều vật liệu bán dẫn.
>> Xem thêm: Kim loại dẫn điện tốt nhất

Dãy điện hóa thể hiện khả năng nhường electron và tính khử của kim loại
3. Phản ứng giữa kim loại và axit
Cơ chế phản ứng và ví dụ minh họa
Một trong những phản ứng quan trọng nhất thể hiện tính chất hóa học của kim loại là phản ứng với dung dịch axit. Khi kim loại tác dụng với axit, chúng đẩy được nguyên tử hiđro ra khỏi phân tử axit, sinh ra muối và giải phóng khí hiđro. Phản ứng xảy ra theo nguyên tắc kim loại nhường electron cho ion H⁺ trong axit, biến H⁺ thành khí H₂ bay lên.
Nếu thả một mảnh kẽm vào dung dịch axit clohiđric, bạn sẽ thấy bọt khí xuất hiện, đó chính là khí hiđro được tạo thành từ phản ứng kẽm + axit → muối kẽm clorua + hiđro. Sắt, nhôm hay magie cũng phản ứng tương tự, nhưng mức độ mạnh yếu khác nhau tùy vị trí trong dãy điện hóa.
Giới hạn của phản ứng
Không phải kim loại nào cũng phản ứng với axit. Những kim loại quý như vàng và platin gần như trơ, không tan trong các loại axit thông thường. Chúng chỉ bị hòa tan trong dung dịch đặc biệt gọi là nước cường toan – hỗn hợp giữa axit nitric và axit clohiđric đặc. Ngược lại, kim loại hoạt động mạnh như natri hay kali lại phản ứng quá mãnh liệt, đến mức không thể tiến hành trong điều kiện thông thường vì sẽ nổ mạnh và gây nguy hiểm.

Kim loại kiềm như natri phản ứng mạnh với nước, tạo dung dịch natri hiđroxit và khí hiđro
4. Phản ứng giữa kim loại và dung dịch muối
Hiện tượng phản ứng thế
Một kim loại có hoạt tính mạnh hơn có thể đẩy kim loại yếu hơn ra khỏi dung dịch muối của nó. Khi thả một thanh sắt vào dung dịch đồng sunfat, ta sẽ thấy bề mặt thanh sắt xuất hiện lớp đồng màu đỏ bám lên. Điều đó chứng tỏ sắt đã đẩy đồng ra khỏi dung dịch muối, phản ứng này gọi là phản ứng thế.
Bản chất của phản ứng là kim loại mạnh hơn nhường electron cho ion kim loại yếu hơn, khiến ion đó trở thành nguyên tử tự do. Nếu xét theo dãy hoạt động hóa học, chỉ những kim loại đứng trước mới có thể đẩy được kim loại đứng sau ra khỏi dung dịch muối.
Ứng dụng trong thực tế
Phản ứng thế có vai trò rất lớn trong công nghiệp và hóa học ứng dụng. Người ta sử dụng nguyên lý này để điều chế kim loại bằng phương pháp hóa học, ví dụ dùng kẽm khử ion bạc trong dung dịch bạc nitrat để thu hồi bạc kim loại. Ngoài ra, phản ứng thế cũng là cơ sở của hoạt động trong pin điện hóa, nơi năng lượng hóa học được chuyển hóa thành năng lượng điện.
Từ những phân tích trên có thể thấy tính chất hóa học của kim loại chủ yếu thể hiện qua khả năng dễ nhường electron, đóng vai trò là chất khử trong hầu hết các phản ứng. Kim loại có thể phản ứng với phi kim để tạo oxit, với axit để giải phóng hiđro, với nước để tạo dung dịch kiềm, với dung dịch muối để đẩy kim loại yếu hơn ra khỏi dung dịch, và thậm chí với kiềm hoặc oxit kim loại khác trong một số trường hợp đặc biệt.
>> Tham khảo: Súng thổi ion SL004


